Наши партнеры ArtmMisto
Берилій (Beryllium) Be - хімічний елемент 2 (IIa) групи Періодичної системи Д. І. Менделєєва. Атомний номер 4, відносна атомна маса 9,01218. У природі зустрічається лише один стабільний ізотоп 9Be. Відомі також радіоактивні ізотопи берилію 7Be і 10Be з періодами напіврозпаду 53.29 днів і 1,6 · 106 років, відповідно. Ступені окислення +2 і +1 (остання вкрай нестійка).
Берілліесодержащіе мінерали відомі з давніх-давен. Деякі з них добувалися на Синайському півострові ще в 17 ст. до н.е. Назва берил зустрічається у грецьких і латинських (Beryll) античних письменників. Подібність берилу і смарагду відзначав Пліній Старший : «Берил, якщо подумати, має ту ж природу, що і смарагд (смарагд), або, по крайней мере, дуже схожу» (Природна історія, книга 37). В Ізборнику Святослава (1073) берил фігурує під назвою вірулліон.
Берилій був відкритий в 1798. Французький кристаллограф і мінералог Рене Жюст Гаюї (Haüy René Just) (1743-1822), зазначивши схожість твердості, щільності та зовнішнього вигляду зеленувато-блакитних кристалів берилу з Ліможа і зелених кристалів смарагду з Перу, запропонував французькому хіміку Нікола Луї Воклену (Vauquelin Nicolas Louis) (1763-1829) проаналізувати берил і смарагд, щоб дізнатися, чи не є вони хімічно ідентичними. В результаті Воклен показав, що обидва мінерали містять не тільки оксиди алюмінію і кремнію, як було відомо і раніше, але також і нову «землю», яка дуже нагадувала оксид алюмінію, але, на відміну від нього, реагувала з карбонатом амонію і не давала квасцов. Саме цими властивостями Воклен і скористався для поділу оксидів алюмінію і невідомого елемента.
Редакція журналу «Annakts de Chimie», що опублікував роботу Воклена, запропонувала для відкритої їм землі назву «гліцину» за здатність до утворення сполук, що володіють солодким смаком. Відомі хіміки Мартін Генріх Клапрот (Klaproth Martin Heinrich) (1743-1817) і Андерс Екеберг (Ekeberg Anders) (1767-1813) вважали цю назву невдалим, так як солі ітрію також мають солодкуватий смак. В їх роботах «земля», відкрита Вокленом, називається берилові. Проте, в науковій літературі 19 ст. для нового елемента довгий час використовували терміни «ГЛІЦ», «гліциній» або «глюціній». У Росії до середини 19 ст. оксид цього елемента називали «сладкоземом», «сладімой землею», «сладоземом» а сам елемент іменувався гліцин, гліцінітом, ГЛІЦ, сладімцем
 У вигляді простого речовини елемент, відкритий Вокленом, вперше отримав німецький хімік Фрідріх Велер (Wöhler Friedrich) (1800-1882) в 1828, восстановлівая хлорид берилію калієм:
У вигляді простого речовини елемент, відкритий Вокленом, вперше отримав німецький хімік Фрідріх Велер (Wöhler Friedrich) (1800-1882) в 1828, восстановлівая хлорид берилію калієм:
BeCl2 + 2K = Be + 2KCl
Незалежно від нього в цьому ж році тим же методом металевий берилій був виділений французьким хіміком Антуаном Бюссі (Bussy Antoine) (1794-1882).
Загальноприйнятим стало назва елемента по імені мінералу (латинське beryllus від грецького bhrnlloV), проте у Франції берилій досі називають гліцин.
Було встановлено, що маса одного еквівалента берилію дорівнює приблизно 4,7 г / моль. Однак подібність між берилієм і алюмінієм призвело до істотного омани щодо валентності і атомної маси берилію. Довгий час берилій вважали тривалентним з відносною атомною масою 14 (що приблизно дорівнює потроєною масі одного еквівалента берилію 3 × 4,7). Лише через 70 років після відкриття берилію російський вчений Д.І. Менделєєв прийшов до висновку, що в його періодичної таблиці місця для такого елемента немає, а ось двовалентний елемент з відносною атомною масою 9 (приблизно рівною подвоєною масі одного еквівалента берилію 2 × 4,7) легко розміщується між літієм і бором.
Берилій в природі і його промислове витяг. Берилій, як і сусідні з ним літій і бор, щодо мало поширений в земній корі, його вміст становить близько 2 · 10-4%. Хоча берилій і рідкісний елемент, але він не є розсіяним, так як входить до складу поверхневих покладів берилу в пегматитових породах, які останніми закристалізуватися в гранітних куполах. Є повідомлення про гігантських берилію довжиною до 1 м і масою до кількох тонн.
Відомо 54 власне берилієвих мінералу. Найважливіший з них - берил 3BeO · Al2O3 · 6SiO2. У нього багато забарвлених різновидів. Смарагд містить близько 2% хрому, що додає йому зелений колір. Аквамарин своєї блакитний забарвленням зобов'язаний домішки заліза (II). Рожевий колір воробьевіта обумовлений домішкою з'єднань марганцю (II), а золотисто-жовтий гелиодор забарвлений іонами заліза (III). Промислово важливими мінералами є також фенакит 2BeO · SiO2, бертрандит 4BeO · 2SiO2 · H2O, гельвін (Mn, Fe, Zn) 4 [BeSiO4] 3S.
Світові природні ресурси берилію оцінюються більш ніж в 80 тис. Т (за змістом берилію), з яких близько 65% зосереджено в США, де основним берилієвим сировиною є бертрандітовая руда. Її підтверджені запаси в США на родовищі Spur Mountain (шт. Юта), що є основним у світі джерелом берилію, на кінець 2000 склали приблизно 19 тис. Т (за змістом металу). Берілла в США дуже мало. З інших країн найбільшими запасами берилію володіють Китай, Росія і Казахстан. За часів СРСР берилій на території Росії добувався на Малишевському (Свердловська область), Завитинском (Читинська область), Ермаковському (Бурятія), Прикордонному (Приморський край) родовищах. У зв'язку зі скороченням ВПК і припиненням будівництва атомних електростанцій, його видобуток було припинено на Малишевському і Ермаковському і значно скорочена на Завітімском родовищах. При цьому значна частина видобутого берилію продається за кордон, в основному, в Європу і Японію.
За оцінкою Геологічної служби США, світовий видобуток берилію у 2000 характеризувалася такими даними (т):
Всього 356 США 255 КНР 55 Росія 40 Казахстан 4 Інші країни 2
Характеристика простого речовини і промислове отримання металевого берилію. За зовнішнім виглядом берилій - сріблясто-сірий метал. Він дуже твердий і крихкий. Берилій має дві кристалічні модифікації: a-Be має грати гексагонального типу (що призводить до анізотропії властивостей); решітка b-Be відноситься до кубічного типу; температура переходу становить один тисяча двісті сімдесят сім ° С. Берилій плавиться при 1 287 ° С, кипить при +2471 ° С.
Це один з найлегших металів (щільність дорівнює 1,816 г / см3). У нього високий модуль пружності, в 4 рази більший, ніж у алюмінію, в 2,5 рази перевищує відповідний параметр титану, і на третину вище, ніж у сталі. Берилій володіє найбільшою серед всіх металів теплоємністю: 16,44 Дж / (моль К) для a-Be, 30,0 Дж / (моль К) для b-Be.
За стійкістю до корозії у вологому повітрі берилій, завдяки освіті захисного оксидного шару, нагадує алюміній. Ретельно відполіровані зразки довго зберігають свій блиск.
Металевий берилій відносно мало реакционноспособен при кімнатній температурі. У компактному вигляді він не реагує з водою і водяною парою навіть при температурі червоного розжарювання і не окислюється повітрям до 600 ° С. Порошок берилію при підпалюванні горить яскравим полум'ям, при цьому утворюються оксид і нітрид. Галогени реагують з берилієм при температурі вище 600 ° С, а халькогена вимагають ще більш високої температури. Аміак взаємодіє з берилієм при температурі вище 1200 ° С з утворенням нітриду Be3N2, а вуглець дає карбід Ве2С при 1700 ° С. З воднем берилій безпосередньо не реагує, і гідрид ВеН2 отримують непрямим шляхом.
Берилій легко розчиняється в розбавлених водних розчинах кислот (соляної, сірчаної, азотної), проте холодна концентрована азотна кислота пасивує метал. Реакція берилію з водними розчинами лугів супроводжується виділенням водню і утворенням гідроксоберіллатов:
Be + 2NaOH (р) + 2H2O = Na2 [Be (OH) 4] + H2
При проведенні реакції з розплавом лугу при 400-500 ° С утворюються діоксоберіллати:
Be + 2NaOH (ж) = Na2BeO2 + H2
Металевий берилій швидко розчиняється у водному розчині NH4HF2. Ця реакція має технологічне значення для отримання безводного BeF2 і очищення берилію:
Металевий берилій швидко розчиняється у водному розчині NH4HF2. Ця реакція має технологічне значення для отримання безводного BeF2 і очищення берилію:
Be + 2NH4HF2 = (NH4) 2 [BeF4] + H2
Берилій виділяють з берилу сульфатним або фторидним способом. У першому випадку концентрат сплавляють при 750 ° С з карбонатом натрію або кальцію, а потім сплав обробляють концентрованою гарячої сірчаної кислотою. На утворився розчин сульфату берилію, алюмінію та інших металів діють сульфатом амонію. Це призводить до виділення більшої частини алюмінію у вигляді алюмокалієвих квасцов. Що залишився розчин обробляють надлишком гідроксиду натрію. При цьому утворюється розчин, що містить Na2 [Be (OH) 4] і алюмінати натрію. При кип'ятінні цього розчину в результаті розкладання гідроксоберіллата осідає гідроксид берилію (алюмінати залишаються в розчині).
За фторидно способу концентрат нагрівають з Na2 [SiF6] і Na2CO3 при 700-750 ° С. При цьому утворюється тетрафтороберіллат натрію:
3BeO · Al2O3 · 6SiO2 + 2Na2 [SiF6] + Na2CO3 = 3Na2 [BeF4] + 8SiO2 + Al2O3 + CO2
Потім витравлюють розчинний фтороберіллат водою і беруть в облогу гідроксид берилію при рН близько 12.
Для виділення металевого берилію його оксид або гідроксид спочатку переводять в хлорид або фторид. Метал отримують електролізом розплавлених сумішей хлоридів берилію і лужних елементів або дією магнію на фторид берилію при температурі близько 1300 ° С:
BeF2 + Mg = MgF2 + Be
Для отримання заготовок і виробів з берилію використовують, в основному, методи порошкової металургії.
Берилій - легирующая добавка в мідних, нікелевих, залізних і інших сплавах. Здатність берилію збільшувати твердість міді була відкрита в 1926. Сплави міді з 1-3% берилію назвали берилієвими бронзами. Зараз відомо, що добавка близько 2% берилію в шість разів збільшують міцність міді. Крім того, такі сплави (які також зазвичай містять 0,25% кобальту) мають хорошу електричну провідність, високу міцність і опір зносу. Вони не магнітні, стійкі до корозії і знаходять численні області застосування в рухомих частинах двигунів літаків, точних інструментах, керуючих реле в електроніці. Крім того, вони не іскрять і тому широко застосовуються для виготовлення ручного інструменту в нафтовій промисловості. Нікелевий сплав, що містить 2% берилію, використовується також для високотемпературних пружин, затискачів, хутра та електричних контактів. Все більшого значення набувають берилій-алюмінієві сплави, в яких вміст берилію досягає 65%. Вони мають широке коло сфер використання - від авіакосмічної промисловості до виробництва комп'ютерів.
За допомогою берилію покращують якість поверхні деталей машин і механізмів. Для цього готовий виріб витримують в порошку берилію при 900-1000 ° С, і його поверхня робиться твердіше, ніж у кращих сортів загартованої сталі.
Ще одна важлива область застосування берилію - в ядерних реакторах, так як він є одним з найбільш ефективних сповільнювачів і відбивачів нейтронів. Його використовують і в якості матеріалу для віконець в рентгенівських трубках. Берилій пропускає рентгенівські промені в 17 разів краще, ніж алюміній і в 8 разів краще, ніж ліндемановское скло.
Суміш з'єднань радію і берилію довгий час використовувалася як зручний лабораторний джерело нейтронів, що утворюються з ядерної реакції:
9Be + 4He = 12C + 1n
У 1932 при використанні саме цієї суміші англійським фізиком Джеймсом Чедвиком був відкритий нейтрон.
У виробництві металевого берилію домінують США (американська фірма «Brush Wellman», що базується в Клівленді). Китай і Казахстан також мають виробничі потужності з випуску металевого берилію.
Споживання берилію в США, де цей метал застосовується найбільше, у 2000 склало приблизно 260 т (за змістом металу), з яких 75% використовувалося у вигляді мідно-берилієвих сплавів для виготовлення пружин, з'єднувачів і перемикачів, застосовуваних в автомобілях, літальних апаратах і комп'ютерах. Протягом 1990-х ціни на мідно-берилієві сплави залишалися стабільними і складали приблизно 400 доларів за кілограм берилію, цей рівень цін зберігається і зараз.
За оцінкою компанії «Roskill», світовий попит на берилій в 2001 різко знизився, зокрема, за рахунок скорочення ринку телекомунікаційного обладнання, що є, ймовірно, найбільшою сферою споживання цього металу. Однак експерти «Roskill» вважають, що в середньостроковій перспективі це зниження буде компенсуватися зростанням попиту на мідно-берилієвих стрічку з боку виробників автомобільних електронних пристроїв і комп'ютерів. У більш віддаленій перспективі, як очікують, триватиме зростання споживання мідно-берилієвих сплавів у виробництві підводного телекомунікаційного обладнання, а також підвищиться попит на труби для нафтогазової промисловості, до складу матеріалу яких входить берилій.
Малоймовірно, що попит на металевий берилій помітно зросте, оскільки ціни на альтернативні матеріали нижче, ніж на берилій, який є досить дорогим металом. Так, в ряді сфер споживання альтернативними йому матеріалами можуть служити графіт, сталь, алюміній і титан, а замість мідно-берилієвих сплавів може використовуватися фосфорна бронза.
Сполуки берилію.
У берилію, на відміну від інших елементів 2 групи, немає з'єднань з переважно іонними зв'язками, в той же час для нього відомі численні координаційні сполуки, а також металоорганічні з'єднання, в яких часто утворюються багатоцентрові зв'язку.
Внаслідок малого розміру атома берилій майже завжди проявляє координаційне число 4, що важливо для аналітичної хімії.
Солі берилію у воді швидко гідролізуються з утворенням ряду гідроксокомплексів невизначеною структури. Осадження починається при відносно OH-: Be2 +> 1. Подальше додавання лугу призводить до розчинення осаду.
Гідрид берилію ВеН2 був вперше отриманий в 1951 відновленням хлориду берилію за допомогою LiAlH4. Він являє собою аморфне білу речовину. При нагріванні до 250 ° С гідрид берилію починає виділяти водень. Це з'єднання помірно стійко в повітрі і воді, але швидко розкладається кислотами. Гідрид берилію полімеризовані за рахунок трехцентрових зв'язків Венвен.
Галогеніди берилію. Безводні нітрати берилію можна отримати реакціями у водних розчинах внаслідок утворення гідратів, таких як [Be (H2O) 4] F2, і гідролізу. Кращим способом для отримання фториду берилію є термічний розклад (NH4) 2 [BeF4], а хлорид берилію зручно отримувати з оксиду. Для цього діють хлором на суміш оксиду берилію і вуглецю при 650-1000 ° С. Хлорид берилію можна також синтезувати прямим високотемпературним хлоруванням металевого берилію або його карбіду. Ці ж реакції використовуються для отримання безводних броміду і йодиду.
Фторид берилію - склоподібний матеріал. Його структура складається з невпорядкованою сітки з атомів берилію (КЧ 4), пов'язаних містками з атомів фтору, і схожа на структуру кварцового скла. Вище 270 ° С фторид берилію мимовільно кристалізується. Подібно кварцу, він існує в низькотемпературної a-формі, яка при 227 ° С переходить в b-форму. Крім того, можна отримати форми кристобалита і трідіміта. Структурна подібність між BeF2 і SiO2 поширюється також на фтороберіллати (які утворюються при взаємодії фториду берилію з фторидами лужних елементів і амонію) і силікати.
Фторид берилію - компонент фтороберіллатних стекол і сольової суміші, використовуваної в ядерних реакторах на розплавлених солях.
Хлорид та інші галогеніди берилію можна розглядати як поліядерних комплексні сполуки, в яких координаційне число берилію дорівнює 4. У кристалах хлориду берилію є нескінченні ланцюжки з мостіковимі атомами хлору
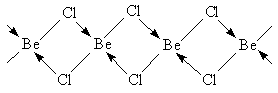
Навіть при температурі кипіння (550 ° С) в газовій фазі міститься близько 20% молекул димарів Be2Cl4.
Цепочечная структура хлориду берилію легко руйнується слабкими лигандами, такими як діетиловий ефір, з утворенням молекулярних комплексів [BeL2Cl2]:

Сильніші донори, такі так вода або аміак, дають іонні комплекси [BeL4] 2+ (Cl-) 2. У присутності надлишку галогенид-іонів утворюються галогенідні комплекси, наприклад [BeF4] 2.
Оксид берилію BeO зустрічається в природі у вигляді рідкісного мінералу бромелліта.
Непрожарений оксид берилію гигроскопичен, адсорбує до 34% води, а прожарений при 1500 ° С - лише 0,18%. Оксид берилію, прожарений не вище 500 ° С, легко взаємодіє з кислотами, важче - з розчинами лугів, а прожарений вище 727 ° С - лише зі фтороводородной кислотою, гарячою концентрованої сірчаної кислотою і расплавами лугів. Оксид берилію стійкий до впливу розплавлених літію, натрію, калію, нікелю і заліза.
Оксид берилію отримують термічним розкладанням сульфату або гідроксиду берилію вище 800 ° С. Продукт високої чистоти утворюється при розкладанні основного ацетату [Be4O (OOCH3) 6] вище 600 ° С.
Оксид берілію має дуже скроню теплопровідність. При 100 ° С вона складає 209,3 Вт / (м К), що більше, ніж у будь-яких неметалів і навіть у деяких металів. Оксид берилію поєднує високу температуру плавлення (2507 ° С) при з незначним тиском пари при температурі нижче цієї. Він служить в якості хімічно стійкого і вогнетривкого матеріалу для виготовлення тиглів, високотемпературних ізоляторів, труб, чохлів для термопар, спеціальної кераміки. В інертному атмосфері або вакуумі тиглі з оксиду берилію можуть застосовуватися при температурах до 2000 ° С.
Хоча оксид берилію часто замінюють дешевшим і менш токсичним нітридом алюмінію, в цих випадках зазвичай спостерігається погіршення робочих характеристик обладнання. Очікують, що в більш віддаленій перспективі продовжиться стабільне зростання споживання оксиду берилію, особливо у виробництві комп'ютерів.
Гідроксид берилію Be (OH) 2 осаджують з водних розчинів солей берилію аміаком або гідроксидом натрію. Його розчинність в воді при кімнатній температурі набагато нижче, ніж у його сусідів за періодичною системою, і становить всього лише 3 · 10-4 г л-1. Гідроксид берилію амфотерен, вступає в реакції як з кислотами, так і з лугами з утворенням солей, в яких берилій входить до складу катіона або аніона, відповідно:
Be (OH) 2 + 2H3O + = Be2 + + 2H2O
Be (OH) 2 + 2OH- = [Be (OH) 4] 2-
Гідроксокарбонат берилію - з'єднання змінного складу. Утворюється при взаємодії водних розчинів солей берилію з карбонатами натрію або амонію. При дії надлишку розчинних карбонатів легко утворює комплексні сполуки, такі як (NH4) 2 [Be (CO3) 2].
Карбоксилати берилію. Унікальність берилію проявляється в освіті стійких летючих молекулярних оксид-карбоксилатов із загальною формулою [OBe4 (RCO2) 6], де R = H, Me, Et, Pr, Ph і т.д. Ці білі кристалічні речовини, типовим представником яких є основний ацетат берилію (R = CH3), добре розчинні в органічних розчинниках, включаючи алкани, і нерозчинні у воді і нижчих спиртах. Їх можна отримати простим кип'ятінням гідроксиду або оксиду берилію з карбоновою кислотою. Структура таких з'єднань містить центральний атом кисню, Тетраедрично оточений чотирма атомами берилію. На шести ребрах цього тетраедра є шість мостікових ацетатних груп, розташованих таким чином, що кожен атом берилію має тетраедричну оточення з чотирьох атомів кисню. Ацетатне з'єднання [OBe4 (MeCO2) 6] плавиться при 285 ° С і кипить при 330 ° С. Воно стійке до нагрівання і окислення в нежорстких умовах, повільно гідролізується гарячою водою, але швидко разлается мінеральними кислотами з утворенням відповідної солі берилію і вільної карбонової кислоти .
Нітрат берилію Be (NO3) 2 при звичайних умовах існує у вигляді тетрагідрат. Він добре розчинний у воді, гігроскопічний. При 60-100 ° С утворюється гідроксонітрат змінного складу. При більш високій температурі він розкладається до оксиду берилію.
Основний нітрат [OBe4 (NO3) 6] має аналогічну карбоксилатов структуру з мостіковимі нітратів-групами. Це з'єднання утворюється при розчиненні хлориду берилію в суміші N2O4 і етилацетату з утворенням кристалічного сольвату [Be (NO3) 2.2N2O4], який потім нагрівають до 50 ° С, щоб отримати безводний нітрат Be (NO3) 2, швидко розкладається при 125 ° С на N2O4 і [OBe4 (NO3) 6].
Берілліеорганіческіе з'єднання. Для берилію відомі численні сполуки, що містять зв'язку берилій-вуглець. З'єднання складу ВеR2, де R - алкіл, є ковалентними і мають полімерну структуру. З'єднання (CH3) 2Be має ланцюговий будова з тетраедричних розташуванням метильних груп навколо атома берилію. Він легко переганяється при нагріванні. У парах існує у вигляді димеру або тримера.
З'єднання R2Be самовоспламеняются на повітрі і в атмосфері діоксиду вуглецю, бурхливо реагують з водою і спиртами, дають стійкі комплекси з амінами, фосфінами, ефірами.
Синтезують R2Be взаємодією хлориду берилію з магнійорганіческіе сполуками в ефірі або металевого берилію з R2Hg. Для отримання (C6H5) 2Be і (C5H5) 2Be використовують реакцію хлориду берилію з відповідними похідними лужних елементів.
Припускають, що сполуки складу RBeX (Х - галоген, OR, NH2, H) представляють собою R2Be.BeX2. Вони менш реакційноздатні, зокрема, на них не діє діоксид вуглецю.
Беріллійорганічеських з'єднання використовують як каталізатори димеризации і полімеризації олефінів, а також для отримання металевого берилію високої чистоти.
Біологічна роль берилію.
Берилій не відноситься до біологічно важливим хімічним елементам. У той же час, підвищений вміст берилію небезпечно для здоров'я. Сполуки берилію дуже отруйні, особливо у вигляді пилу і диму, мають алергічних і канцерогенну дію, подразнюють шкіру і слизові оболонки. При попаданні в легені можуть викликати хронічне захворювання - бериліоз (легенева недостатність). Захворювання легенів, шкіри та слизових оболонок можуть виникнути через 10-15 років після припинення контакту з берилієм.
Вважають, що токсичні властивості цього елемента пов'язані зі здатністю Be (II) заміщати Mg (II) в магніесодержащіх ферментах за рахунок його більш сильною координаційної здібності.
Олена Савинкина





