Наши партнеры ArtmMisto
Спектр (від лат. Spectrum - уявлення, образ) - є сукупністю кожного із значень будь-якої фізичної величини , Яка характеризує систему або процес.
Найчастіше використовують визначення частотного спектра коливань (наприклад, електромагнітних), спектру енергій, імпульсів і мас часток. Спектр може бути безперервним і дискретним (переривчастим).
Оптичні спектри - це спектри електромагнітних випромінювань в ІК, видимому і UF діапазонах довжин хвиль. Оптичні спектри діляться на спектри випускання, спектри поглинання (абсорбція спектри), спектри розсіювання і спектри відображення.
Оптичні спектри отримують від джерел світла при розкладанні їх випромінювання по довжинах хвиль λ (або частотам v = c / λ, або хвильовим числам 1 / λ = v / c, які також позначаються як v) за допомогою спектральних приладів. Щоб охарактеризувати розподіл випромінювання по частотах, вводиться спектральна щільність випромінювання I (v), яка дорівнює інтенсивності випромінювання I, яка припадає на одиничний інтервал частот (інтенсивність випромінювання I є щільністю потоку електромагнітного випромінювання, що припадає на всі частоти). Інтенсивність випромінювання, що припадає на маленький спектральний інтервал Δv, дорівнює I (v) Δv. Підсумувавши подібні вирази по всіх частотах спектра, отримуємо щільність потоку випромінювання I.
Види спектрів.
Спектральний склад випромінювання речовин дуже різноманітний, але незважаючи на це, кожен спектр ділиться на 3 типи:
- безперервні спектри,
- лінійчатих спектри,
- смугасті спектри.
Безперервні спектри, або суцільні спектри, як видно з дослідів, дають тіла, які знаходяться в твердому або рідкому стані, або дуже стислі гази. Що б отримати безперервний спектр, тіло необхідно нагріти до високої температури.
Безперервні спектри визначаються не тільки випромінювальною здатністю самих атомів, але у великій мірі залежать від взаємодії атомів один з одним.
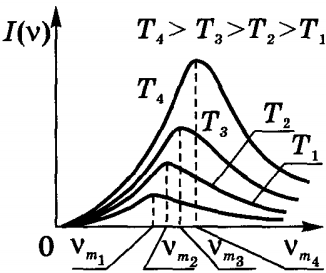
На малюнку ви бачите криву залежності спектральної щільності інтенсивності теплового випромінювання від частоти (спектр) тіла з сильно чорною поверхнею. У кривої є максимум при частоті vm a x, яка залежить від температури тіла. Зі збільшенням температури максимум енергії випромінювання зсувається до великих частотах. Енергія випромінювання, що припадає на дуже маленькі (v → 0) і дуже великі (v → ∞) частоти, дуже мала. У суцільному спектрі представлені кожна з довжин хвиль.
Лінійчаті спектри складаються з окремих спектральних ліній, це ознака того, що речовина випромінює світло конкретних довжин хвиль в певних, дуже вузьких спектральних інтервалах. Всі лінії мають кінцеву довжину.
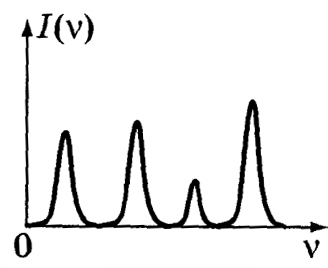
Лінійчаті спектри дають всі речовини в газоподібному атомарному (але не молекулярному) стані. В такому випадку випромінюють атоми, які не взаємодіють один з одним. Це фундаментальний, самий основний тип спектрів.
Ізольовані атоми випромінюють строго певні довжини хвиль, характерні для даного типу атомів. Класичним прикладом лінійного спектра є спектр атома водню .
Спектральні закономірності в спектрі атома водню.
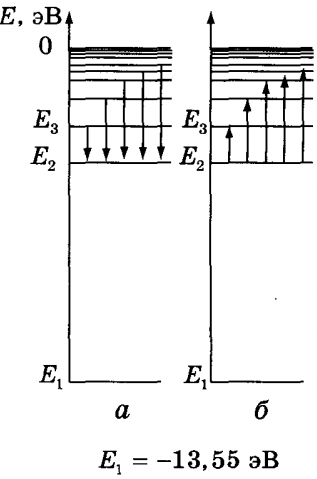
Кожна частота випромінювань атома водню становить ряд серій, кожна з яких утворюється в процесі переходу атома в одне з енергетичних станів з усіх верхніх енергетичних станів, тобто станів з більшою енергією, використовуючи термінологію спектроскопії - переходів електрона з верхніх збуджених рівнів енергії на нижні рівні.
 .
.
На малюнку а) ви можете побачити переходи на 2-ий збуджений енергетичний рівень, які складають серію Бальмера, частоти випромінювання якої знаходяться у видимій області спектра. Серія має назву по імені швейцарського вчителя І. Бальмера, який ще в 1885 році грунтуючись на результатах експериментів вивів формулу для визначення частот видимої частини спектра водню:
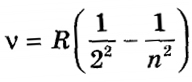
де n - 3, 4, 5, ...;
R - постійна Рідберга, яка визначена з спектральних даних і пізніше обчислена грунтуючись на теорії атома Бора .
У цій формулі v - НЕ частота, яка вимірюється в с-1, а хвильове число, яке дорівнює зворотному значенню довжини хвилі 1 / λ і яке вимірюється в м-1.
Що б визначити частоти випромінювання інших серій атома водню замість двійки в знаменнику першого дробу у формулі 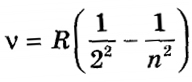 необхідно підставити числа 1, 3, 4, 5.
необхідно підставити числа 1, 3, 4, 5.
Номери нижніх енергетичних рівнів, при переході на які з верхніх рівнів випромінюються відповідні серії:

Смугасті спектри складаються з окремих смуг, які розділені темними проміжками. За допомогою досить хорошого спектрального апарата можна побачити, що всі смуги складаються з великого числа близько лежачі ліній. Смугасті спектри випромінюють молекули, які не пов'язані або слабо пов'язані один з одним.
Для спостереження молекулярних спектрів, як і для спостереження лінійчатих спектрів, застосовують світіння парів у полум'ї або світіння газового розряду.
Спектри поглинання теж діляться на 3 типи (суцільні, лінійчатих і смугасті), що і спектри випускання. Поглинання світла теж залежить від довжини хвилі. Так, червоне скло пропускає хвилі, які відповідають червоного світла (λ ≈ 8 · 10-5 см), і поглинає інші.
Газ інтенсивніше всіх поглинає світло тих довжин хвиль, які він випускає в сильно нагрітому стані.
Таким чином, якщо пропускати біле світло через холодний неизлучающий газ, то на тлі безперервного спектра випромінювання з'являться темні лінії. Це лінії поглинання, які утворюють в сукупності спектр поглинання.





