Наши партнеры ArtmMisto
Внутрішню енергію тіла складають кінетична енергія всіх його молекул і потенціальна енергія їх взаємодії.
Внутрішня енергія входить до балансу енергетичних перетворень в природі. Після відкриття внутрішньої енергії був сформульований закон збереження і перетворення енергії. Розглянемо взаємне перетворення механічної і внутрішньої енергій. Нехай на свинцевою плиті лежить свинцевий куля . Піднімемо його вгору і відпустимо. Коли ми підняли кулю, то повідомили йому потенційну енергію. При падінні кулі вона зменшується, т. К. Куля опускається все нижче і нижче. Але зі збільшенням швидкості поступово збільшується кінетична енергія кулі. Відбувається перетворення потенційної енергії кулі в кінетичну. Але ось куля вдарився об свинцеву плиту і зупинився. І кінетична, і потенційна енергії його щодо плити стали рівними нулю. Розглядаючи куля і плиту після удару, ми побачимо, що їх стан змінилося: куля трохи сплюснувся, і на плиті утворилася невелика вм'ятина; вимірявши ж їх температуру , Ми виявимо, що вони нагрілися.
Нагрівання означає збільшення середньої кінетичної енергії молекул тіла. При деформації змінюється взаємне розташування частинок тіла, тому змінюється і їх потенційна енергія.
Таким чином, можна стверджувати, що в результаті удару кулі об плиту відбувається перетворення механічної енергії, якою володів на початку досліду куля, у внутрішню енергію тіла.
Неважко спостерігати і зворотний перехід внутрішньої енергії в механічну.
Наприклад, якщо взяти товстостінну скляну посудину і накачати в нього повітря через отвір в пробці, то через якийсь час пробка з посудини вилетить. У цей момент в посудині утворюється туман. Поява туману означає, що повітря в посудині став холодніше і, отже, його внутрішня енергія зменшилася. Пояснюється це тим, що знаходився в посудині стиснене повітря, виштовхуючи пробку (т. Е. Розширюючись), зробив роботу за рахунок зменшення своєї внутрішньої енергії. Кінетична енергія пробки збільшилася за рахунок внутрішньої енергії стисненого повітря.
Таким чином, одним із способів зміни внутрішньої енергії тіла є робота, що здійснюються молекулами тіла (або іншими тілами) над даним тілом. Способом зміни внутрішньої енергії без здійснення роботи є теплопередача.
Оскільки молекули ідеального газу не взаємодіють один з одним, їх потенційна енергія вважається рівною нулю. Внутрішня енергія ідеального газу визначається тільки кінетичної енергією безладного поступального руху його молекул. Для її обчислення потрібно помножити середню кінетичну енергію одного атома 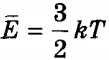 на число атомів
на число атомів 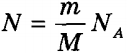 . З огляду на, що k NA = R, отримаємо значення внутрішньої енергії ідеального газу :
. З огляду на, що k NA = R, отримаємо значення внутрішньої енергії ідеального газу :
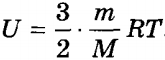 .
.
Внутрішня енергія ідеального одноатомного газу прямо пропорційна його температурі. якщо скористатися рівнянням Клапейрона-Менделєєва , То вираз для внутрішньої енергії ідеального газу можна представити у вигляді:
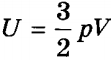 .
.
Слід зазначити, що, відповідно до виразу для середньої кінетичної енергії одного атома 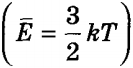 і в силу хаотичності руху, на кожне з трьох можливих напрямків руху, або кожну ступінь свободи, по осі X, Y і Z доводиться однакова енергія
і в силу хаотичності руху, на кожне з трьох можливих напрямків руху, або кожну ступінь свободи, по осі X, Y і Z доводиться однакова енергія 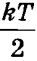 .
.
Число ступенів свободи - це число можливих незалежних напрямків руху молекули.
Газ, кожна молекула якого складається з двох атомів, називається двоатомний. Кожен атом може рухатися по трьох напрямках, тому загальне число можливих напрямків руху - 6. За рахунок зв'язку між молекулами число ступенів свободи зменшується на одну, тому число ступенів свободи для двоатомних молекули дорівнює п'яти.
Середня кінетична енергія двоатомних молекули дорівнює 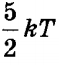 . Відповідно внутрішня енергія ідеального двоатомних газу дорівнює:
. Відповідно внутрішня енергія ідеального двоатомних газу дорівнює:
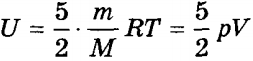 .
.
Формули для внутрішньої енергії ідеального газу можна узагальнити:
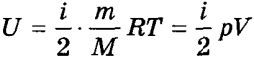 .
.
де i - число ступенів свободи молекул газу (i = 3 для одноатомного і i = 5 для двоатомних газу).
Для ідеальних газів внутрішня енергія залежить тільки від одного макроскопічного параметра - температури і не залежить від обсягу, т. К. Потенційна енергія дорівнює нулю (обсяг визначає середня відстань між молекулами).
Для реальних газів потенційна енергія не дорівнює нулю. Тому внутрішня енергія в термодинаміці в загальному випадку однозначно визначається параметрами, котрі характеризують стан цих тел: об'ємом (V) і температурою (T).





