Наши партнеры ArtmMisto
кількість теплоти, що поглинається тілом при нагріванні на 1 градус; точніше - відношення кількості теплоти, що поглинається тілом при нескінченно малій зміні його температури, до цієї зміни Т. одиниці маси речовини (г, кг) називається питомою теплоємністю, 1 благаючи речовини - мольной (молярної) Т.
Кількість теплоти, поглиненої тілом при зміні його стану, залежить не тільки від початкового і кінцевого станів (зокрема, від їх температури), але і від способу, яким був здійснений процес переходу між ними. Відповідно від способу нагрівання тіла залежить і його Т. Зазвичай розрізняють Т. при постійному об'ємі (C v) і Т. при постійному тиску (Ср), якщо в процесі нагрівання підтримуються постійними відповідно його обсяг або тиск. При нагріванні при постійному тиску частина теплоти йде на виробництво роботи розширення тіла, а частина - на збільшення його внутрішньої енергії (Див. Внутрішня енергія ), Тоді як при нагріванні при постійному об'ємі вся теплота витрачається тільки на збільшення внутрішньої енергії; в зв'язку з цим cp завжди більше, ніж cv. Для газів (розріджених настільки, що їх можна вважати ідеальними) різниця молярних Т. дорівнює cp - cv = R, де R - універсальна газова постійна , Що дорівнює 8,314 дж / (моль. К), або 1,986 кал / (моль. Град). У рідин і твердих тіл різниця між Ср і Cv порівняно мала. Теоретичне обчислення Т., зокрема її залежності від температури тіла, не може бути здійснено за допомогою чисто термодинамічних методів і вимагає застосування методів статистичної фізики (Див. статистична фізика ). Для газів обчислення Т. зводиться до обчислення середньої енергії теплового руху окремих молекул. Цей рух складається з поступального і обертального рухів молекули як цілого і з коливань атомів всередині молекули. Відповідно до класичної статистикою (тобто статистичної фізики, заснованої на класичній механіці), на кожну ступінь свободи поступального і обертального рухів доводиться в мольной Т. (Cv) газу величина, рівна. R / 2; а на кожну коливальну ступінь свободи - R, це правило називається равнораспределенія закон ом. Частка одноатомного газу володіє всього трьома поступальними ступенями свободи, відповідно чому його Т. повинна складати 3/2 R [тобто близько 12,5 дж / кмоль. К), або 3 кал / (моль.град)], що добре узгоджується з досвідом. Молекула двоатомних газу володіє трьома поступальними, двома обертовими і однієї коливальної ступенями свободи, і закон равнораспределенія призводить до значення Cv = ½R; між тим досвід показує, що Т. двоатомних газу (при звичайних температурах) складає всього 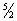 R. Це розбіжність теорії з експериментом пов'язано з тим, що при обчисленні Т. необхідно враховувати квантові ефекти, тобто користуватися статистикою, заснованої на квантовій механіці (Див. Квантова механіка ). Згідно з квантовою механікою, всяка система часток, що здійснюють коливання або обертання (в тому числі молекула газу), може мати лише певними дискретними значеннями енергії. Якщо енергія теплового руху в системі недостатня для збудження коливань певної частоти, то ці коливання не вносять свого вкладу в Т. системи (відповідна ступінь свободи виявляється «замороженою» - до неї непридатний закон равнораспределенія). Температура Т, при досягненні якої закон равнораспределенія виявляється застосовним до обертальної або коливальної ступеня свободи, визначається квантово-механічним співвідношенням T >> hv / k (v - частота коливань, h - планка постійна , K - Больцмана постійна ). Інтервали між обертальними рівнями енергії двоатомних молекули (поділені на k) складають всього кілька градусів і лише для такої легкої молекули, як молекула водню, досягають сотні градусів. Тому при звичайних температурах обертальна частина Т. двоатомних (а також багатоатомних) газів підкоряється закону равнораспределенія. Інтервали ж між коливальними рівнями енергії досягають декількох тисяч градусів і тому при звичайних температурах закон равнораспределенія абсолютно непридатний до коливальної частини Т. Обчислення Т. з квантової статистики призводить до того, що коливальна Т. швидко убуває при зниженні температури, прагнучи до нуля. Цим пояснюється та обставина, що вже при звичайних температурах коливальна частина Т. практично відсутня і Т. двоатомних газу дорівнює
R. Це розбіжність теорії з експериментом пов'язано з тим, що при обчисленні Т. необхідно враховувати квантові ефекти, тобто користуватися статистикою, заснованої на квантовій механіці (Див. Квантова механіка ). Згідно з квантовою механікою, всяка система часток, що здійснюють коливання або обертання (в тому числі молекула газу), може мати лише певними дискретними значеннями енергії. Якщо енергія теплового руху в системі недостатня для збудження коливань певної частоти, то ці коливання не вносять свого вкладу в Т. системи (відповідна ступінь свободи виявляється «замороженою» - до неї непридатний закон равнораспределенія). Температура Т, при досягненні якої закон равнораспределенія виявляється застосовним до обертальної або коливальної ступеня свободи, визначається квантово-механічним співвідношенням T >> hv / k (v - частота коливань, h - планка постійна , K - Больцмана постійна ). Інтервали між обертальними рівнями енергії двоатомних молекули (поділені на k) складають всього кілька градусів і лише для такої легкої молекули, як молекула водню, досягають сотні градусів. Тому при звичайних температурах обертальна частина Т. двоатомних (а також багатоатомних) газів підкоряється закону равнораспределенія. Інтервали ж між коливальними рівнями енергії досягають декількох тисяч градусів і тому при звичайних температурах закон равнораспределенія абсолютно непридатний до коливальної частини Т. Обчислення Т. з квантової статистики призводить до того, що коливальна Т. швидко убуває при зниженні температури, прагнучи до нуля. Цим пояснюється та обставина, що вже при звичайних температурах коливальна частина Т. практично відсутня і Т. двоатомних газу дорівнює 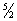 R замість ½ R. При досить низьких температурах Т. взагалі повинна обчислюватися за допомогою квантової статистики. Як виявляється, Т. убуває з пониженням температури, прагнучи до нуля при Т → 0 в згоді з так званому принципом Нернста (третім початком термодинаміки (Див. Третій закон термодинаміки )). У твердих (кристалічних) тілах тепловий рух атомів являє собою малі коливання поблизу певних положень рівноваги (вузлів кристалічної решітки). Кожен атом має, таким чином, трьома коливальними ступенями свободи і, відповідно до закону равнораспределенія, мольная Т. твердого тіла (Т. кристалічної решітки) повинна бути рівною 3 nR, де n - число атомів в молекулі. Насправді, однак, це значення - лише межа, до якого прагнуть Т. твердого тіла при високих температурах. Його можна досягти вже при звичайних температурах у багатьох елементів, в тому числі металів (Див. метали ) (N = 1, так званий Дюлонга і Пті закон ) І у деяких простих з'єднань [NaCI, MnS (n = 2), PbCl2 (n = 3) і ін.]; у складних з'єднань цю межу фактично ніколи не досягається, т. к. ще раніше настає плавлення речовини або його розкладання. Квантова теорія Т. твердих тіл була розвинена А. Ейнштейн ом (1907) і П. Дебаєм (Див. Дебай ) (1912). Вона заснована на квантуванні коливального руху атомів в кристалі. При низьких температурах Т. твердого тіла виявляється пропорційною кубу абсолютної температури (так званий закон Дебая). Критерієм, що дозволяє розрізняти високі і низькі температури, є порівняння з характерним для кожного даної речовини параметром - так званої характеристичної, або дебаєвської, температурою ΘD. Ця величина визначається спектром коливань атомів в тілі і, тим самим, істотно залежить від його кристалічної структури. Зазвичай ΘD - величина порядку декількох сот К, але може досягати (наприклад, у алмазу) і тисяч К (див. Дебая температура ).
R замість ½ R. При досить низьких температурах Т. взагалі повинна обчислюватися за допомогою квантової статистики. Як виявляється, Т. убуває з пониженням температури, прагнучи до нуля при Т → 0 в згоді з так званому принципом Нернста (третім початком термодинаміки (Див. Третій закон термодинаміки )). У твердих (кристалічних) тілах тепловий рух атомів являє собою малі коливання поблизу певних положень рівноваги (вузлів кристалічної решітки). Кожен атом має, таким чином, трьома коливальними ступенями свободи і, відповідно до закону равнораспределенія, мольная Т. твердого тіла (Т. кристалічної решітки) повинна бути рівною 3 nR, де n - число атомів в молекулі. Насправді, однак, це значення - лише межа, до якого прагнуть Т. твердого тіла при високих температурах. Його можна досягти вже при звичайних температурах у багатьох елементів, в тому числі металів (Див. метали ) (N = 1, так званий Дюлонга і Пті закон ) І у деяких простих з'єднань [NaCI, MnS (n = 2), PbCl2 (n = 3) і ін.]; у складних з'єднань цю межу фактично ніколи не досягається, т. к. ще раніше настає плавлення речовини або його розкладання. Квантова теорія Т. твердих тіл була розвинена А. Ейнштейн ом (1907) і П. Дебаєм (Див. Дебай ) (1912). Вона заснована на квантуванні коливального руху атомів в кристалі. При низьких температурах Т. твердого тіла виявляється пропорційною кубу абсолютної температури (так званий закон Дебая). Критерієм, що дозволяє розрізняти високі і низькі температури, є порівняння з характерним для кожного даної речовини параметром - так званої характеристичної, або дебаєвської, температурою ΘD. Ця величина визначається спектром коливань атомів в тілі і, тим самим, істотно залежить від його кристалічної структури. Зазвичай ΘD - величина порядку декількох сот К, але може досягати (наприклад, у алмазу) і тисяч К (див. Дебая температура ).
У металів певний внесок в Т. дають також і електрони провідності. Ця частина Т. може бути обчислена за допомогою квантової статистики Фермі, якій підпорядковуються електрони. Електронна Т. металу пропорційна першого ступеня абсолютної температури. Вона являє собою, однак, порівняно малу величину, її вклад в Т. стає істотним лише при температурах, близьких до абсолютного нуля (порядку декількох градусів), коли звичайна Т., пов'язана з коливаннями атомів кристалічної решітки, являє собою ще меншу величину.
Нижче наводяться значення Т. [ккал / (кг. Град)] деяких газів, рідин і твердих тіл при температурі 0 ° С і атмосферному тиску (1 ккал = 4,19 кдж).
Азот. .................. 6,8 Свинець ............... .0,030
Водень ............ 6,84 Кварц ............... ..0,174
Залізо ............ ..0,104 Спирт етиловий ... 0,547
Мідь ............... ... 0,091 Алюміній ......... .0,210
Вода. .......... ...... .1,008
Літ .: Кикоин І. К., Кикоин А. До ,, Молекулярна фізика, М., 1963; Ландау Л. Д., Ліфшиц Е. М., Статистична фізика, 2 вид., М., 1964 (Теоретична фізика, т. 5).
Е. М. Ліфшиц.





